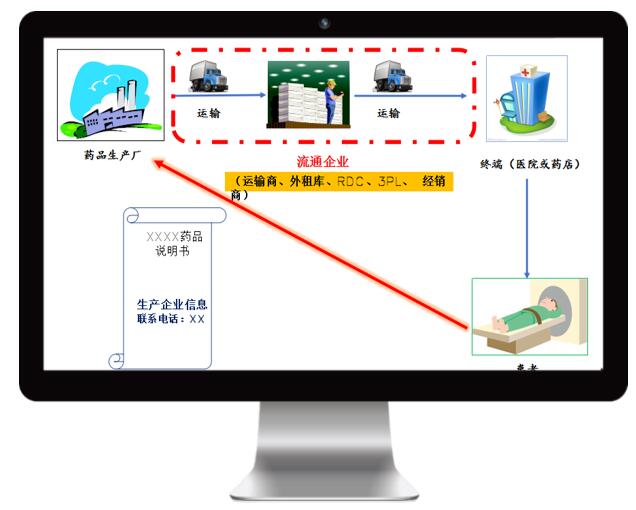
關(guān)于藥品經(jīng)營企業(yè)的冷鏈驗證、GSP驗證活動,藥品管理法明確提出了要強化動態(tài)監(jiān)管,從之前單純的認證轉(zhuǎn)型為動態(tài)的事中事后監(jiān)管。這說明關(guān)于GSP驗證與冷鏈驗證方面,監(jiān)管力度正在持續(xù)加強、監(jiān)管形式已經(jīng)發(fā)生了轉(zhuǎn)變。
《藥品管理法》第三十一條,藥品上市許可持有人應(yīng)當(dāng)建立藥品質(zhì)量保證體系,配備專門人員獨立負責(zé)藥品質(zhì)量管理。藥品上市許可持有人應(yīng)當(dāng)對受托藥品生產(chǎn)企業(yè)、藥品經(jīng)營企業(yè)的質(zhì)量管理體系進行定期審核,監(jiān)督其持續(xù)具備質(zhì)量保證和控制能力。——藥品上市許可持有人履行藥品管理的責(zé)任和義務(wù)。
關(guān)于冷鏈驗證的發(fā)展——測試評價與確認階段。這個階段的冷鏈驗證主要確認設(shè)施設(shè)備是否適用;對冷鏈相關(guān)設(shè)施設(shè)備參數(shù)、性能的確認;通過GSP驗證分析測試數(shù)據(jù)調(diào)整或改進設(shè)施設(shè)備性能以達到預(yù)期目標(biāo)。
關(guān)于冷鏈驗證的發(fā)展——供應(yīng)鏈審計、質(zhì)量追溯階段。到了這一階段,質(zhì)量管理理念發(fā)生變化:對產(chǎn)品整個生命周期的質(zhì)量負責(zé);確認產(chǎn)品的質(zhì)量管理活動符合產(chǎn)品的特性、工藝、儲運等要求:冷鏈驗證以溫度保障為前提,風(fēng)險預(yù)防與管理為核心;保證各項設(shè)施設(shè)備及管理系統(tǒng)始終處于完好、適用狀態(tài)。

































 電話 400 898 7116
電話 400 898 7116


